コロナ後遺症とは?(定義・症状・メカニズム)
新型コロナウイルス感染症(COVID-19)にかかった後、ほとんどの方は時間経過とともに症状が改善します。新型コロナウイルスに感染しても重症化する人は非常に減りました。しかし軽症で済んでも一部の方で症状が長引く方(罹患後症状,いわゆる後遺症)がみられます。
コロナ後遺症について、2024年1月5日までに報告されていることについてお伝えします。
目次
WHOによるコロナ後遺症の定義
WHO(世界保健機関)では、後遺症(post COVID-19 condition)について、「新型コロナウイルスに罹患した人にみられ、少なくとも2カ月以上持続し、また、他の疾患による症状として説明がつかないもの(通常はCOVID-19の発症から3カ月経った時点にもみられる。)」と定義しています。
コロナ後遺症の特徴
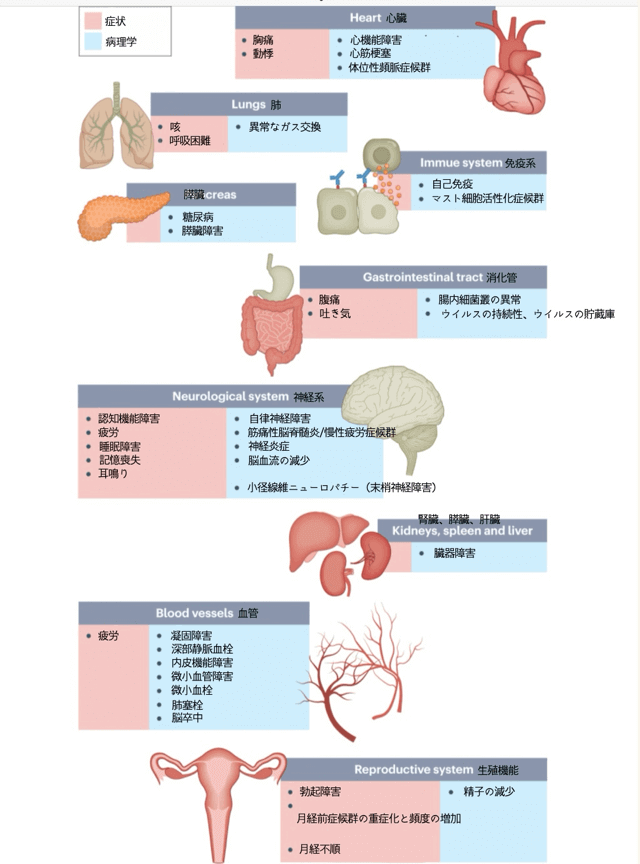
コロナ後遺症は、すべての年齢にみられ、36歳から50歳の割合が多いです。中でも、女性、特に40~50歳の女性の有病率が高いです。ほとんどが感染当初は症状が軽度の非入院患者です。多くの場合、コロナウイルスの影響が複数の臓器系にわたってみられ、数十の症状が挙げられています(下図)。
コロナ感染は、血栓性、心血管および脳血管疾患、2型糖尿病、筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)および自律神経失調症(特に体位性頻脈症候群(POTS))などの疾患の新たな発症に関連しています。
コロナ後遺症では、下図のような症状がみられます。全ての症状が1人の方にみられるわけではなく、このうちのどれか、または複数みられます。
コロナウイルスはACE2を受容体として細胞内に侵入し感染し、種々の臓器障害を惹起します。ACE2は体の多くの細胞で発現するため、コロナウイルスはほとんどの臓器に感染する可能性があります。
コロナ後遺症は、子供も標的にする可能性があります。感染当初にほとんど無症状の場合もあり、コロナにかかった自覚がないお子さんにもコロナ後遺症が起こりうります。
コロナにかかった影響で、極度の疲労、息切れ、筋肉痛、胸部不快感、動悸、頭痛、認知能力の低下が起こり、極度の倦怠感、息切れなどの症状が引き起こされることが子どもにもよくあり、それが6か月以上続きます。
潜在的な危険因子には、女性、2型糖尿病、EBウイルス(体内潜伏ウイルスの1つ)の再活性化、特定の自己抗体の存在、結合組織障害、注意欠陥多動性障害、慢性蕁麻疹、アレルギー性鼻炎が含まれます。ですが、コロナ後遺症の人の3分の1は、基礎疾患(持病)を有しません。
コロナ後遺症のメカニズムの仮説
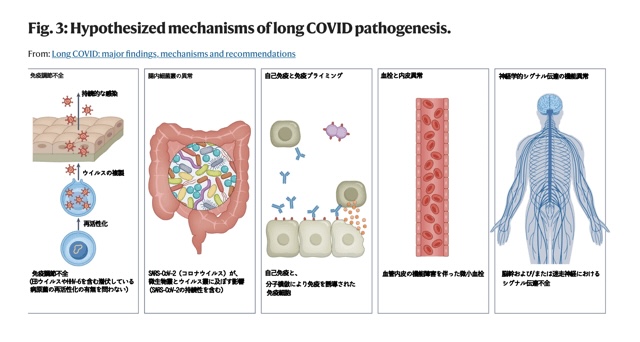
コロナ後遺症の病因にはいくつかのメカニズムが考えられています。
感染の急性期に起きた組織損傷の残存の他に、免疫調節不全、腸内微生物叢の破壊、自己免疫の誘導、凝固および内皮異常、神経シグナル伝達機能不全などです。
免疫調節不全
コロナ後遺症の根本原因に関する主な疾患仮説には、コロナウイルスの組織内への持続性(感染性ウイルス、ウイルスRNA、またはウイルスタンパク質)、潜伏ウイルスの再活性化、その他の免疫調節不全、感染によって引き起こされる自己免疫、微生物叢の破壊、凝固および内皮異常、神経シグナル伝達機能不全など、いくつかのメカニズムが考えられています。
ウイルスの持続性
脳、副鼻腔、副腎、腎臓、腸、リンパ節、脾臓、肺および心臓におけるウイルス抗原、ウイルスRNA、および全ウイルスの残留が実証されています。
ある研究では、血液中のSARS-CoV-2スパイク抗原は、診断後12ヶ月までコロナ後遺症患者37人の60%で発見されたのに対し、SARS-CoV-2に感染しコロナ後遺症のない26人では0%でした。このことより、コロナ後遺症患者では、活発なウイルスまたはウイルスの成分を貯蔵している可能性が高いです。実際、胃腸生検後の複数の報告は、一部の患者に持続的なウイルスの貯蔵を示唆しています。
ウイルスの持続性は、
- 直接的なウイルスによる細胞障害
- 局所的な炎症
- 免疫反応を誘発し、炎症の亢進および長期化を誘発
- 自己免疫の促進
などを起こしてきます。
ウイルスが持続することで免疫細胞を過剰に刺激し、サイトカインストームを起こし、最終的にはウイルス除去に必要な免疫細胞を枯渇させてしまう可能性があります。さらに、ウイルスはその分子相同性(分子の化学的構造の類似性)により、免疫監視やウイルス除去を回避できる可能性があります。
体内に潜伏していたウイルスの再活性化
ヘルペスウイルス科のウイルスのほとんどは、人体に初感染の後、潜伏感染します。これは冬眠状態のようなものです。私たちの体内には数種類のウイルスがどこかに眠っており、体調が悪化したときに冬眠状態から目覚めて増殖を開始します。これをウイルスの再活性化といいます。
EBウイルスやHHV-6を含む再活性化されたウイルスは、コロナ後遺症(およびME/CFSと診断されている)の患者に認められ、この再活性化は炎症源になる他、ミトコンドリアの断片化につながりエネルギー代謝に深刻な影響を与えます。ヘルペス科のEBウイルスの再活性化は、コロナ後遺症患者の疲労と神経認知機能障害と関連しているとされています。
腸内細菌叢の異常
コロナの影響とヒト(宿主)の腸内細菌叢との間に強い相関関係があり、コロナ後遺症のリスク増加との関連が言われています。病原性細菌の大幅な増加、それと同時に起こる炎症を抑える微生物叢の減少は、新型コロナウイルス感染症期間中の持続的な腸炎を促進し、その後の回復を妨げ長期化につながります。
コロナウイルスのRNAはコロナ患者の便サンプルに存在し、ある研究では、コロナの診断後4ヶ月後に参加者の12.7%、診断後7ヶ月に参加者の3.8%の糞便にコロナウイルスのRNAが認められ、持続性を確認しています。
他の報告でも、コロナ後遺症と炎症性腸疾患を持つほとんどの患者は、感染から7ヶ月後に腸粘膜に抗原の持続性がみられています。
別の報告では、腸および/または肺上皮に真菌の増加がみられ、このことによりサイトカイン産生を誘発する可能性が考えられています。
コロナ後遺症患者の腸内微生物叢は、コロナウイルス感染の診断後1年経っても完全には回復していないことが判明しました。腸内細菌叢の直接的な異常だけでなく、腸漏れ症候群(リーキーガット症候群)を起こしており、粘膜バリアの破壊と腸内細菌の成分や代謝物が体内の血流循環へ入り込んでいることを示唆する証拠が蓄積されています。
腸内細菌叢の異常で起こる腸内毒素症(Dysbiosis)では、良性細菌の減少と悪性細菌の増加を認めますが、さらに菌の種類の多さ、つまり多様性が減少していることがわかっています。
コロナ後遺症に関連する腸内毒素症で、最も一般的な 3 つの症状は、睡眠障害 (35.5%)、記憶に関する認知障害 (44.5%)、および疲労 (50.9%) でした。
自己免疫および分子相同性による免疫系のプライミング
分子相同性とは、分子の化学的構造の類似性のことで、自己免疫疾患の原因となります。
例えば、抗原となるウイルスの一部が、自分の細胞が発現するタンパク質の構造と似ていると、その自分の細胞も外的と認識して攻撃してしまいます。本来、外敵を攻撃するために働く免疫細胞に、外敵と分子構造がよく似ている自分自身が攻撃されてしまう状態のことです。
複数の研究で、ACE2(SARS-CoV-2侵入の受容体)、β2-アドレナリン受容体、ムスカリンM2受容体、アンジオテンシンII AT1受容体、アンジオテンシン1-7 MAS受容体に対する自己抗体の上昇をコロナ後遺症の患者で認めました。
組織を標的とする自己抗体(結合組織、細胞外マトリックス成分、血管内皮、凝固因子、血小板など)、臓器系(肺、中枢神経系、皮膚および消化管を含む)、免疫調節タンパク質(サイトカイン、ケモカイン、補体成分および細胞表面タンパク質)を含む自己抗体が高レベルで存在するとされています。
ウイルス感染後の自己免疫の誘導は、コロナウイルスに特異的なものではなく、エプスタイン・バーウイルス(EBウイルス)、サイトメガロウイルスなどで報告されています。
内皮機能障害を伴う微小血栓
血管内皮は血管の内腔則にある細胞で、血管の健康と恒常性の調節に不可欠です。
新型コロナウイルスに感染したことのない人と比較して、コロナ後遺症患者では微小血栓がみられ、血栓が持続し続けることを裏付ける証拠が急速に増えています。
新型コロナウイルス感染症 は、内皮機能不全/内皮症/内皮炎により多臓器疾患を引き起こす可能性があります(臓器を栄養する血管が傷害されると、臓器障害を起こします。また、臓器内の小型血管が血管炎を起こすと臓器炎を起こします)。
内皮機能不全では、血管収縮、炎症、凝固促進が起こります。この血栓は溶解(消失)しずらく、溶解時に炎症を促進する炎症性分子を含みます。
さまざまな毛細血管の微小循環の閉塞が組織機能不全を引き起こします。そして、最終的には臓器の調節不全および機能不全を引き起こし、臓器系に関連する臨床症状に至ると仮定されています。
脳幹および/または迷走神経におけるシグナル伝達機能不全
脳幹には、呼吸器、心血管、胃腸、神経系を調節する多数の異なる生命維持に重要な中枢が存在します。
また、脳幹は他の脳領域に比べてACE2受容体の発現が比較的高いため、コロナウイルスはそこで影響を及ぼしやすいです。
ニューロン(神経細胞)は容易には再生しないため、脳幹の機能障害による症状は長期化しやすいです。
脳幹機能不全は、慢性疼痛や片頭痛、筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)など、他の同様の疾患にも関与していると考えられています。
コロナ後遺症とME/CFSの患者では、脳のMRI変化が類似しているそうです。両方のグループが橋と脳幹全体の体積が大幅に大きいことが報告されています(さらに、コロナ後遺症患者では上小脳脚の体積も増加)。
ME/CFS患者およびコロナ後遺症患者の脳幹の部分領域および脳幹全体の体積が、痛みや呼吸困難の臨床測定と有意に関連しており、脳幹の体積が大きいほど痛みの重症度が高いことが実証されています。
神経学的シグナル伝達の機能異常
神経学的および認知症状は、コロナ後遺症の主要な症状です。感覚運動症状、記憶喪失、認知障害、感覚異常、めまい、光と騒音に対する感受性、匂いや味の喪失、自律神経機能障害ながあり、しばしば日常生活に影響を与えます。コロナ後遺症の聴覚前庭神経症状には、耳鳴り、難聴、めまいが含まれます。
これらのメカニズムには、神経炎症、血栓による血管の損傷、内皮機能障害、ニューロンへの損傷が含まれます。
コロナ後遺症の患者にいて、アルツハイマー病のようなシグナル伝達、神経に有毒なアミロイド塊へ変化するペプチド、広範な神経炎症、脳と脳幹の低代謝、異常な脳脊髄液の所見がみられたという報告があります。
多系統の細胞調節不全とミエリン(神経を包み込んで保護している物質)の喪失が、軽症のコロナ感染後のコロナ後遺症の方でみられることが報告されています。
対照個体だけでなく、コロナ感染前後の同じ患者の脳イメージングを含む英国のバイオバンクの研究では、眼窩前頭皮質と傍海馬回の灰白質の厚さ(一次嗅覚皮質に関連する領域の組織損傷のマーカー)が減少し、入院していない患者でも対照と比較して、コロナ後の脳サイズが全体的に減少し、認知機能低下が大きいことが示されました。
他の報告では、コロナウイルスのスパイクおよびヌクレオカプシドタンパク質が中枢神経系で発見されています。
ME/CFS(筋痛性脳脊髄炎/慢性疲労症候群)、自律神経障害
多くの研究者が、ME/CFSとコロナ後遺症との類似性について言及しています。
コロナ後遺症の約半数は、ME/CFSの基準を満たしていると推定されており、ME/CFSの主要症状である運動後倦怠感を、コロナ後遺症の大多数が経験しています。
ME/CFSは、ウイルスまたは細菌感染の後に発症する多系統神経免疫疾患です。
基準には、「少なくとも6ヶ月間、職業的、教育的、社会的、または個人的な活動の能力が、病気前レベルと比べ大幅な減少または障害されている」ことが含まれ、運動後の倦怠感、すっきりしない睡眠、認知障害、または起立性不耐症を伴います。
幅広い病原体がME/CFSを引き起こすため、ME/CFSがコロナ感染に起因することは驚くべきことではありません。
ME/CFSにおける一貫した異常な所見には、免疫の異常(ナチュラルキラー細胞機能の低下、T細胞の枯渇およびその他のT細胞異常)、ミトコンドリア機能障害、および変形した赤血球および血液量の減少を含む血管および内皮異常が含まれます。その他の異常には、運動不耐症、酸素消費障害、無酸素性作業閾値の低下、および脂肪酸やアミノ酸の使用の変化を含む異常な代謝、神経炎症、脳血流の減少、脳幹異常、心室乳酸レベルの上昇、異常な眼や視力の所見など、神経機能の変化も観察されています。再活性化されたヘルペスウイルス(EBV、HHV-6、HHV-7、ヒトサイトメガロウイルスを含む)もME/CFSと関連していると、報告されています。
コロナ後遺症患者では、血中コルチゾール(副腎ホルモン)の低下を示しています。副腎によるコルチゾール産生の低下は、下垂体による副腎皮質刺激ホルモン(ACTH)産生の増加によって、正常の状態では補充されるべきところです。
ですが、コロナ後遺症ではそうではなく、視床下部-下垂体-副腎軸の機能不全がみられ、コルチゾールが適切量に調節されていないということです。これは、根底にある神経炎症過程を反映している可能性があります。低コルチゾールレベルは、以前にME/CFSの論文でも報告されています。
コロナ後遺症の研究では、ミトコンドリアの機能異常があるとの報告も多数あります。このミトコンドリアの機能異常も、エネエルギー源であるATP産生の効率が悪くなり、慢性に続く疲労感・Brain fogの原因となっています。
自律神経障害、特にPOTS(体位性頻脈症候群)は、一般的にME/CFSにもみられ、、しばしばウイルス感染に関連します。POTSは、自律神経の受容体(Gタンパク質結合アドレナリン受容体、ムスカリンアセチルコリン受容体)に対する自己抗体、血小板貯蔵プール欠乏症、小繊維神経障害等と関連しています。POTSと小繊維神経障害の両方が、コロナ後遺症の患者に一般的に見られます。ある研究では、コロナ後遺症のの67%でPOTSが見つかりました。
マスト細胞活性化症候群も一般的にME/CFSにもみられます。マスト細胞活性化症候群の症状の数と重症度は、コロナ以前の患者および対照個人と比較してコロナ後遺症患者で大幅に増加しました。
まとめ
コロナ後遺症の病因にはいくつかのメカニズムが考えられています。
免疫調節不全、腸内内細菌叢の異常、自己免疫の誘導、ACE2受容体へのコロナウイルスのスパイク蛋白結合によるACE2酵素の減少により、炎症が進みます。
それに微小血栓の問題も加わり、多彩な症状を引き起こしてきます。


